Die Stammzellentherapie und ihr Nutzen - Dr. Hans S. Keirstead
- Details
- Kategorie: Stammzellforschung
Dr. Hans S. Keirstead, Privatdozent für Anatomie und Neurobiologie am Reeve-Irvine Research Center, University of California in Irvine, U.S.A., arbeitet im Auftrag von Families of SMA, an einem Projekt für Stammzellforschung. Er sucht nach Möglichkeiten der Therapie für SMA-Patienten. Nachfolgend ist seine Zusammenfassung in deutscher Übersetzung nachzulesen.
Stammzellentherapie von Dr. Hans Keirstead
Zusammenfassung: Die Stammzellentherapie und ihr Nutzen
Die Spinale Muskelatrophie (SMA) ist eine der am weitesten verbreiteten genetischen Erkrankungen, die bereits in der Kindheit zum Tod führen. SMA zerstört die Motoneuronen, die die willkürliche Muskelbewegung regeln, und macht die Muskeln schlaff und schwach. Der SMA Typ I oder das Werding-Hoffman-Syndrom ist die schwerste Form der SMA. Bei Kindern mit SMA Typ I zeigen sich die Symptome typischerweise im Alter von sechs Monaten: Sie haben Schwierigkeiten zu atmen, zu schlucken und zu saugen und erreichen nie die Fähigkeit, ohne fremde Hilfe zu sitzen.
Es gibt Behandlungen, die die Komplikationen von SMA lindern können, jedoch gibt es keine Heilung. Trotzdem hält die US-amerikanische Behörde NIH („National Institutes of Health“) die SMA für eines der neurologisch-genetischen Leiden, für die es in der nahen Zukunft am ehesten eine erfolgreiche Behandlung oder Heilung geben kann. Bis jetzt konzentrieren sich die primären Ansätze zur Behandlung oder Heilung von SMA auf zwei Vorgehensweisen: Zum Ersten auf die genetische Therapie, d.h. die Beeinflussung des genetischen Materials, welches für das Entstehen der SMA verantwortlich zeichnet, und zum Zweiten auf eine Zellersatztherapie, bei der abgestorbene oder absterbende Motoneuronen durch neue ersetzt werden.
Humane embryonale Stammzellen (hESCs) sind für die Zellersatzstrategie äußerst viel versprechend – aufgrund ihrer Fähigkeit, jede Zelle des menschlichen Körpers generieren zu können (jeder Mensch besteht aus seinen hESCs), und ihrer scheinbar unbegrenzten Fähigkeit, sich selbst zu kopieren (was es ermöglicht, enorm große Mengen von Zellen zu generieren). Die Fähigkeit, hESCs auf enorme Anzahlen zu amplifizieren, existiert bereits. Aus hESCs medizinisch brauchbare Zellbestände zu generieren war bisher eines der größten Hindernisse, mit denen sich hESC-Forscher konfrontiert sahen. Wie bringen wir hESCs dazu, eben dieser eine Zelltyp zu werden, den wir uns zur Behandlung einer bestimmten menschlichen Erkrankung ersehnen? Zum ersten Mal hat die Keirstead-Forschungsgruppe an der University of California in Irvine, U.S.A., hochreine Zellen aus hESCs produziert. In diesen Studien brachten Forscher hESCs dazu, ein bestimmter Hirnzellentyp zu werden, nämlich Oligodendrozyten mit einer Reinheit von mehr als 95% – im Hinblick auf die Behandlung von Rückenmarksverletzungen.
Dies ist eine bedeutsame Leistung, da die meisten Ableitungen des Zellbestandes von hESCs weniger als 20% rein waren und einen stark gemischten Bestand an Zelltypen beinhalteten. Hochreine Zellbestände sind aber entscheidend, da wir nicht unnötiges Material in den Krankheitsbereich injizieren wollen, das sich möglicherweise ungünstig verhalten würde. Zellen aus Zehennägeln beispielsweise in den Bereich einer Rückenmarksverletzung zu injizieren würde wahrscheinlich wenig dazu beitragen, die Erkrankung zu behandeln. Als Ergebnis unserer erfolgreichen Fähigkeit, purifizierte Zellbestände von Oligodendrozyten aus hESCs zu generieren, wird voraussichtlich 2008 eine klinische Studie mit Patienten mit Rückenmarksverletzungen beginnen.
Die Keirstead-Forschungsgruppe war in der Lage, menschliche Motoneuronen aus hESCs zu entwickeln. Mit intellektueller Unterstützung von Dr. Douglas Kerr und finanzieller Unterstützung der „Families of Spinal Muscular Atrophy“ haben wir Wege entwickelt, um hESCs dahin zu lenken, zu hochreinen menschlichen Motoneuronen zu werden. Wir testen derzeit die Zellen in Tiermodellen, um zu bestimmen, ob sie in einem lebenden System funktionieren können und ob die Behandlung ungefährlich ist.
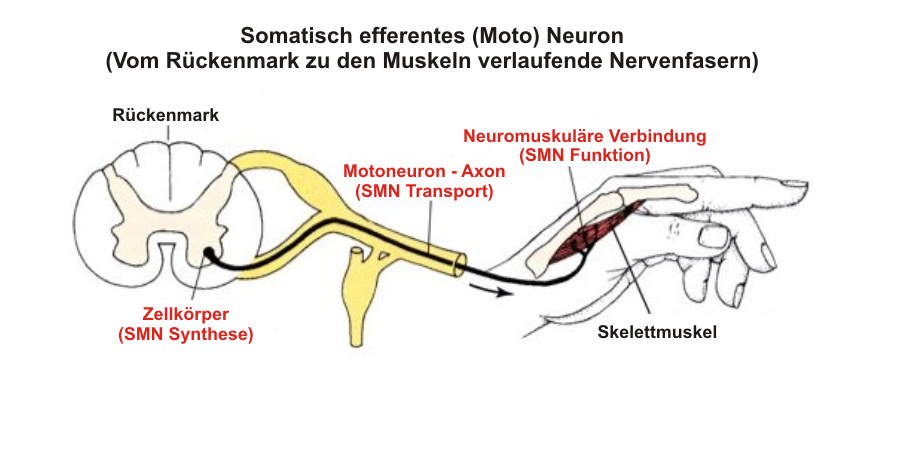
Schaubild 1. Diagramm eines Motoneurons
Im oben stehenden Diagramm ist deutlich zu sehen, dass ein Motoneuron extrem lang ist. Das eine Ende des Motoneurons (links), als Zellkörper bezeichnet, befindet sich im Rückenmark. Das ist der Ort, an dem sich die Transplantation von Ersatz-Motoneuronen ereignen würde. Das transplantierte Neuron müsste dann einen sehr langen Ausläufer, Axon genannt, vom Rückenmark zum Muskel aussenden. Der Bereich, in dem das Axon des Motoneurons mit einem Skelettmuskel Kontakt schließt, nennt sich neuromuskuläre Verbindung (rechts). Die Gesamtlänge eines einzelnen Motoneurons (vom Rückenmark bis zum Muskel) kann in der Größenordnung von ca. 30 bis 90 cm liegen (die gesamte Bahn des Axons ist hier in schwarz gezeigt). Dies trifft normalerweise nicht bei älteren Kindern oder Erwachsenen zu. Beachten Sie, dass viele Axone (schwarz) zusammengebündelt einen Nerv bilden (gelb).
Die jüngsten Patienten mit SMA Typ I wären besonders empfänglich für diese Art der Therapie, da diese Patienten üblicherweise kleine Kinder sind und die Erkrankung selbst eine relativ einfache Symptomatik aufweist. Zuerst wurde das Ziel identifiziert, nämlich die Motoneuronen; also wissen wir, was wir ersetzen müssen. SMA steht in Kontrast zu anderen Erkrankungen wie z.B. Hirnschlag und Rückenmarksverletzungen, wo eine komplexe Symptomatik mit vielen verschiedenen Zielsetzungen verbunden ist, die oftmals schwierig zu definieren sind.
Zweitens sind Patienten mit neu diagnostizierter SMA Typ I winzige Babys, deren spinale Umgebung Nährstoffe für ein Transplantat unterstützen und bereitstellen würde. Ein neugeborenes Kind wächst noch schnell und die Transplantatsumgebung ist hier nicht so feindlich, wie sie mit einem Hirnschlag oder einer Rückenmarksverletzung wäre, wo die Verletzungsbereiche oftmals nicht über eine entsprechende Durchblutung oder über Wachstums- und Entwicklungsfaktoren verfügen, die die Zellen am Leben erhalten. Zudem gibt es sehr wenig Traumata um die Zellen bei Patienten mit SMA Typ I. Diese „ruhigen“ Bedingungen machen das Überleben transplantierter Motoneuronen wahrscheinlicher.
Und letztlich ist das, was wir von transplantierten Motoneuronen bei Neugeborenen erwarten, nicht so schwierig, wie dies bei älteren Patienten der Fall wäre. Bei Neugeborenen hätten die Motoneuronen höchstwahrscheinlich die Fähigkeit, Verbindungen zu den Muskeln hinauswachsen zu lassen, da die Entfernung kurz ist. Bei älteren Patienten würde sich dies als schwieriger erweisen, da sie bedeutend größer sind. Außerdem enthalten die Bahnen, entlang denen die Verbindungen wachsen, bei älteren Patienten aktive Wachstumshemmer – bei Neugeborenen fehlen diese aktiven Wachstumshemmer oder sind sehr vermindert, also ist die Wachstumswahrscheinlichkeit hier viel größer. Diese Tatsachen bedeuten, dass die erfolgreiche Anwendung dieses Ansatzes bei älteren Patienten zusätzliche Eingriffe erfordern würde, um kräftigeres Wachstum anzuregen und die aktiven Wachstumshemmer zu überwinden. Die Forschung hierzu dauert derzeit an. Das Fehlen dieser zusätzlichen Herausforderungen bei Neugeborenen deutet darauf hin, dass wir möglicherweise in der Lage sein werden, sie eher behandeln zu können.
US-amerikanische Bundesbehörden ordnen an, dass klinische Studien nur dann in Betracht gezogen werden können, wenn die Forschung unter ordnungsgemäßer Haftung und Verantwortlichkeit, dem korrekten Führen von Aufzeichnungen sowie mit dem Nachweis, dass die Behandlung ungefährlich ist, durchgeführt worden ist. Diese Aufgabe wird durch Verantwortliche für behördliche Qualitätssicherung ausgeführt, die die Forschungsarbeit so beaufsichtigen, dass sie den behördlichen Verfügungen genügt. Ohne eine solche Beaufsichtigung muss die Forschung unter den wachsamen Augen eines Aufzeichnungen führenden Verantwortlichen für behördliche Qualitätssicherung wiederholt werden. Die Forschung wiederholen zu müssen bedeutet jedoch eine erhebliche Verzögerung und finanzielle Belastung. Verantwortliche für behördliche Qualitätssicherung sind in unserer Gruppe mit dabei und überwachen die Motoneuronen-Forschung. Diese Art von Beaufsichtigung beschleunigt die Übertragung der Laborforschung an Ratten auf klinische Versuche beim Menschen erheblich.
Für unser Forschungs- und Aufsichtsteam ist es spannend, dass wir nun in einer Phase sind, in der wir eine Behandlung erproben können, und wir arbeiten so sorgfältig und schnell wie möglich daran. Im Jahr 2008 werden in den Vereinigten Staaten zum ersten Mal menschliche Testpersonen Behandlungen für Rückenmarksverletzungen erhalten unter Anwendung einer Strategie mit menschlichen Stammzellen, die von unserem Team entwickelt wurde. Unser Ziel ist, sicherzustellen, dass SMA Typ I Gegenstand der zweiten klinischen Studie zu menschlichen Stammzellen ist.
Dr. Hans S. Keirstead ist Privatdozent für Anatomie und Neurobiologie am Reeve-Irvine Research Center, University of California in Irvine, U.S.A.,
Michelle AuCoin ist Direktorin für behördliche Qualitätssicherung in der Keirstead-Forschungsgruppe.
Quelle: Families of SMA, USA - Hier ist der link zu dem Original-Artikel.